Cell子刊:首都医科大学张晨/王伟/刘希成团队揭示肠道细菌通过抑制铁死亡,减轻阿尔茨海默病
来源:生物世界 2024-11-09 09:59
该研究确定了卵形拟杆菌触发的调控阿尔茨海默病病理的通路,并表明使用单一肠道细菌、代谢物或小分子化合物可能是目前阿尔茨海默病预防和治疗方法的补充。
首都医科大学张晨教授、王伟教授、刘希成教授等在 Cell 子刊 Cell Metabolism 上发表了题为:Microbiota-derived lysophosphatidylcholine alleviates Alzheimer’s disease pathology via suppressing ferroptosis 的研究论文。
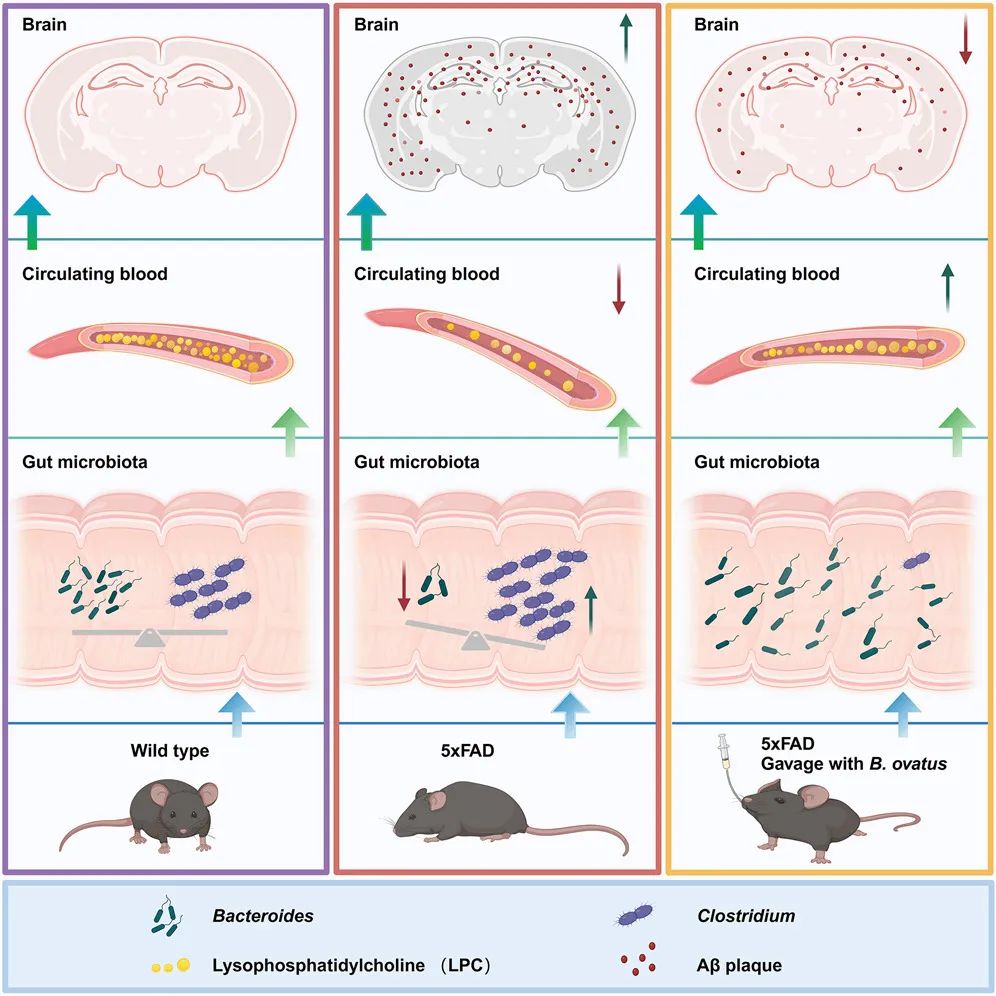
该研究发现,梭菌属的扩张和拟杆菌属的缺失是阿尔茨海默病小鼠模型中与Aβ负荷相关的关键特征,提出了一种依赖于拟杆菌-溶血磷脂酰胆碱(LPC)-GPR119-铁死亡信号轴的阿尔茨海默病调节机制,补充卵形拟杆菌或其代谢产物溶血磷脂酰胆碱(LPC)可改善阿尔茨海默病病理。

近年来,肠道微生物群日益受到关注。多项研究显示,阿尔茨海默病小鼠模型和阿尔茨海默病患者存在肠道菌群失调的问题,并发现他们的肠道微生物丰度和多样性分别与野生型小鼠和对照参与者相比存在显著差异。
值得注意的是,无菌淀粉样变性转基因小鼠模型和抗生素处理的无特定病原体阿尔茨海默病小鼠模型的Aβ斑块沉积显著减少,将淀粉样变性转基因小鼠模型的肠道微生物群转移到无菌淀粉样变性转基因小鼠,会导致后者大脑中增加了Aβ病理。虽然抗生素疗法在动物模型中显示出有前景的治疗效果,但在人类中广泛实施这些措施在可行性和伦理方面可能具有挑战性。
肠道微生物来源的代谢物是理解肠道微生物影响大脑生理和病理机制的焦点之一。最近有研究显示,肠道微生物组成的改变导致外周微生物代谢产物的积累,这有助于阿尔茨海默病相关的神经炎症。此外,越来越多的研究表明,在正常小鼠和阿尔茨海默病小鼠模型中,肠道微生物和相关代谢产物调节小胶质细胞的成熟和功能,并损害少突胶质细胞的成熟。这些发现揭示了肠道微生物的代谢产物影响神经胶质细胞稳态和阿尔茨海默病患者的复杂行为。
然而,阿尔茨海默病中肠道微生物组成的精确变化仍不完全清楚,肠道微生物和相关代谢物在阿尔茨海默病发病机制中的具体功能仍不清楚,而且肠道微生物群失调介导肠-脑相互作用的潜在机制也不完全清楚。
在这项最新研究中,研究团队探索了肠道微生物与阿尔茨海默病进展的相关性,并建立了调节阿尔茨海默病症状的肠道-微生物-脑信号轴。
具体来说,研究团队通过阿尔茨海默病小鼠模型(5xFAD模型),观察到肠道微生物的变化与阿尔茨海默病病理发展之间的显著相关性。梭菌属的扩张和拟杆菌属的缺失是阿尔茨海默病小鼠模型中与Aβ负荷相关的关键特征。值得注意的是,将拟杆菌和溶血磷脂酰胆碱(LPC)递送到阿尔茨海默病小鼠模型,发现可以减少Aβ斑块的负荷,挽救突触功能,改善认知障碍,减少胶质细胞增生和减轻髓鞘变性。
最后,研究团队发现,与健康对照组相比,阿尔茨海默病患者粪便中拟杆菌属的丰度降低,血清中溶血磷脂酰胆碱(LPC)的表达降低。卵形拟杆菌或溶血磷脂酰胆碱(LPC)干预有望成为阿尔茨海默病的潜在治疗途径。
从机制上来说,LPC通过孤儿受体GPR119发挥作用,抑制ACSL4的表达,从而抑制铁死亡并改善了阿尔茨海默病病理。对阿尔茨海默病患者粪便和血清样本的分析也表明,他们的拟杆菌和LPC水平降低。
总的来说,该研究确定了卵形拟杆菌触发的调控阿尔茨海默病病理的通路,并表明使用单一肠道细菌、代谢物或小分子化合物可能是目前阿尔茨海默病预防和治疗方法的补充。
总的来说,该研究发现了一种依赖于拟杆菌-LPC-GPR119-铁死亡信号轴的阿尔茨海默病调节机制,证明了LPC不仅能改善Aβ的积累,还能减轻突触功能障碍,神经胶质增生和髓鞘变性,而这些作用是通过调控铁死亡信号通路实现的。这些发现表明,卵形拟杆菌、其代谢产物溶血磷脂酰胆碱(LPC)或GPR119激动剂,有望成为阿尔茨海默病的潜在治疗方法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


